Ở nhiều loài thú, cá thể cái (XX) mang số gen liên kết với X nhiều gấp đôi so với trên cá thể đực (XY). Làm thế nào để các tế bào kiểm soát biểu hiện gen để giải quyết vấn đề liều lượng gen vốn có khả năng gây chết này? Hãy tìm hiểu hiện tượng bất hoạt nhiễm sắc thể X dưới đây. (Lưu ý, bài viết chỉ đề cập tới sự bù trừ lượng gen trên thú).
Không như nhiễm sắc thể Y ít gen, nhiễm sắc thể X chứa hơn 1.000 gen rất cần thiết cho sự phát triển và khả năng sống của tế bào. Tuy nhiên, con cái mang hai nhiễm sắc thể X, dẫn đến một lượng gấp đôi các gen liên kết X có khả năng gây độc. Để khắc phục sự mất cân bằng này, ở những cá thể cái thuộc động vật có vú đã phát triển một cơ chế đặc biệt để bù trừ lượng gen, khác biệt với cơ chế được sử dụng bởi các sinh vật như ruồi và giun. Đặc biệt, theo một quá trình được gọi là bất hoạt nhiễm sắc thể X (XCI), các động vật có vú cái đã bất hoạt về mặt phiên mã một trong hai X của chúng theo cách thức phức tạp [20]. Nhiễm sắc thể X bất hoạt sau đó co đặc lại thành một cấu trúc nhỏ gọn gọi là thể Barr và nó được duy trì ổn định ở trạng thái bất hoạt [2].
Một ví dụ điển hình của việc bất hoạt X là trong việc tạo màu lông cho mèo tam thể (Hình 1). Ở mèo, gen quy định màu lông có liên kết với X và tùy thuộc vào bản sao nhiễm sắc thể X mà mỗi tế bào chọn để hoạt động, kết quả là màu lông màu cam hoặc đen. Bất hoạt X chỉ xảy ra trong các tế bào có nhiều nhiễm sắc thể X, điều này giải thích tại sao hầu hết tất cả mèo tam thể là cái (Cơ chế được giải thích rõ hơn ở phần dưới).
Bất hoạt X tồn tại ở hai dạng khác nhau: ngẫu nhiên và in dấu. Mặc dù cả hai dạng sử dụng cùng một loại RNA và các enzyme làm bất hoạt, chúng khác nhau về thời gian phát triển và cơ chế hoạt động của chúng.
Contents
RNA không mã hóa và bất hoạt nhiễm sắc thể X
Như đã đề cập trước đó, RNA đóng vai trò quan trọng trong quá trình khử hoạt tính X. Cụ thể, hai RNA không mã hóa, bổ sung nhau là XIST và TSIX, bắt đầu và kiểm soát quá trình bất hoạt.
XIST sinh ra để bất hoạt
XIST, hay X-inactive specific transcript, được phát hiện do biểu hiện đặc hiệu của nó từ nhiễm sắc thể X không hoạt động. RNA này có bốn tính chất độc đáo [1, 3, 4, 6]:
1) Gen XIST không mã hóa protein mà tạo ra phân tử RNA chức năng 17 kilobase (kb). Do đó, nó là một RNA không mã hóa [7].
2) XIST RNA chỉ biểu hiện trong các tế bào cho tối thiểu 2 Xs và thường không biểu hiện trong tế bào đực. Tăng biểu hiện XIST có thể được quan sát thấy trong các tế bào có nhiều X hơn, như là một cơ chế đếm cho phép chỉ một X hoạt động mỗi tế bào. Trong các tế bào này, XIST biểu hiện ở tất cả các Xs thừa.
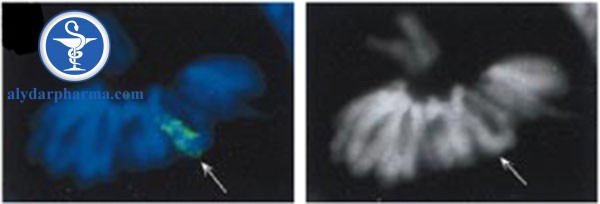
3) XIST RNA tồn tại duy nhất trong nhân và có thể bọc lấy nhiễm sắc thể đã tạo ra nó (điều hòa cis) (Hình 2).
4) Nghịch lý thay, XIST RNA được biểu hiện từ nhiễm sắc thể X không hoạt động.
Nghiên cứu đã chỉ ra rằng XIST RNA là cần thiết và đủ để bất hoạt [24, 29], và nó tập các phức hợp protein bất hoạt khác nhau để đánh dấu nhiễm sắc thể X (sẽ) không hoạt động. Tăng biểu hiện XIST chính là một sự kiện khởi đầu quan trọng trong quá trình bất hoạt X, cho thấy vai trò trung tâm của RNA không mã hóa này.
TSIX – đối kháng XIST
Vậy, tại sao XIST được biểu hiện từ một nhiễm sắc thể X này trong khi gen này lại “câm nín” trên X còn lại (nếu cả hai nhiễm sắc thể đều biểu hiện XIST theo cách đó thì cả hai X sẽ bị bất hoạt mất)? Câu trả lời cho câu hỏi này được đưa ra chỉ vài năm sau khi phát hiện ra XIST, khi RNA antisense của XIST là TSIX đã được xác định [16]. Thuật ngữ “antisense” dùng để cho biết thực ra TSIX là trình tự bổ sung của XIST. TSIX cũng là một RNA dài (40 kilobase), không mã hóa, nhưng nó được phiên mã theo hướng ngược lại trên DNA và bao trùm gen XIST. Giống như XIST, TSIX chỉ hoạt động trên nhiễm sắc thể tạo ra nó. Hơn nữa, có một tỉ lệ nghịch giữa biểu hiện TSIX và XIST: Khi giảm phiên mã TSIX trên một X, biểu hiện XIST tăng lên và dẫn đến bất hoạt nhiễm sắc thể X đó [15, 26]. Ngược lại, sự biểu hiện mạnh của TSIX hạn chế biểu hiện XIST và ngăn chặn sự bất hoạt trên cùng X đó [19, 28]. Những quan sát này cho thấy rằng cần phải có biểu hiện của TSIX để đối kháng XIST trên X (sẽ) hoạt động trong tương lai.
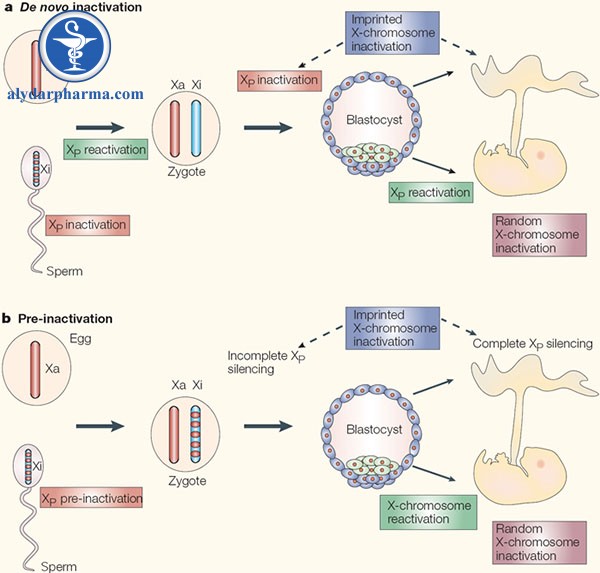
Bất hoạt X nhờ in dấu: Bất hoạt ưu tiên của bố
Như đã đề cập trước đó trong bài viết, có hai loại bất hoạt X: in dấu và ngẫu nhiên. Trong quá trình bất hoạt X, nhiễm sắc thể X của cha được ưu tiên bất hoạt ở nhau thai của thú có nhau, hoặc trong tất cả các tế bào của những loài thú tiến hóa sớm, chẳng hạn như thú túi [9, 12]. Thú vị là, XIST và TSIX đều quan trọng đối với XCI in dấu trên chuột (một loài thú nhau), nhưng thú túi không có gen XIST [8, 14, 26]. Điều này đặt ra câu hỏi tế bào của những loài thú túi có thể bất hoạt X theo cơ chế in dấu mà không cần sử dụng XIST. Một cơ chế có thể giải thích là tiền bất hoạt X của bố ngay từ dòng mầm đực, đó là một quá trình mà cả hai nhiễm sắc thể giới tính bị bất hoạt trong phân bào; khi đó, trạng thái không hoạt động của X có thể được truyền sang thế hệ tiếp theo [11, 12, 22]. Từ quan điểm tiến hóa, một dạng bất hoạt X được thừa hưởng như vậy sẽ đạt được sự bù đắp liều lượng gen một cách dễ dàng và tiết kiệm, bởi vì chỉ có con cái thừa hưởng nhiễm sắc thể X từ cha của chúng.
Điều thú vị là tàn dư của loại cơ chế này vẫn có thể tồn tại ở thú nhau, chẳng hạn như chuột [12]. Trong khi tranh luận vẫn còn liên quan đến các chi tiết về cách thức và thời điểm diễn ra sự bù trừ liều lượng gen, rõ ràng XCI nhờ in dấu đầu tiên xảy ra trong tất cả các tế bào phôi trước khi phôi làm tổ trong tử cung – ở những động vật có nhau đầu tiên [12, 23]. Cùng với thực tế là các loài thú tiến hóa sớm, chẳng hạn như thú túi, cũng chỉ bất hoạt X của bố, XCI in dấu có thể đại diện cho một dạng bất hoạt X từ tổ tiên mang màu sắc tiến hóa. Xuất hiện trước khi có XIST và TSIX, XCI in dấu đã dẫn đến sự tiến hóa của XCI ngẫu nhiên ở thú có nhau.
Bất hoạt X ngẫu nhiên
Bất hoạt X ngẫu nhiên xảy ra ở phôi cái sớm, trong đó cả nhiễm sắc thể X của mẹ và của bố đều có cơ hội bị bất hoạt như nhau (Hình 3). Mỗi tế bào cái có nhiệm vụ khó khăn là cố gắng phân biệt hai nhiễm sắc thể X trong cùng một nhân, sau đó chỉ định một nhiễm sắc thể X hoạt động và một X không hoạt động. Quá trình bất hoạt phức tạp này được thực hiện độc lập trong mỗi tế bào, phần lớn là dựa vào XIST và TSIX.
Các tế bào gốc phôi (ES) có thể trải qua quá trình bất hoạt X ngẫu nhiên khi biệt hóa in vitro [21, 25] và do đó chúng trở thành một hệ thống mô hình tốt để nghiên cứu hiện tượng này. Trên thực tế, việc sử dụng các tế bào ES cùng với phôi chuột sớm đã cho phép các nhà di truyền học mổ xẻ các giai đoạn khác nhau của con đường XCI ngẫu nhiên. Dường như đầu tiên mỗi tế bào đếm số lượng nhiễm sắc thể X của nó, sau đó chọn ngẫu nhiên một X để duy trì hoạt động và cuối cùng, làm bất hoạt X còn lại [3]. Sự bất hoạt toàn bộ một nhiễm sắc thể liên quan đến việc tập hợp nhiều yếu tố chuyên biệt, chẳng hạn như các biến thể histone và các protein tương tác chromatin [18].
Ngoài việc bất hoạt một trong hai X, tế bào cũng phải đảm bảo rằng X còn lại vẫn hoạt động. Vì vậy, phải có một cách để hai X “giao tiếp” với nhau để chỉ định số phận của nhau. Điều thú vị là các bằng chứng gần đây cho thấy sự giao tiếp này được trung gian bởi sự ghép cặp phụ thuộc protein và phiên mã giữa các X trong quá trình phát triển ban đầu [30].
Tại sao tiến hóa cách bất hoạt X ngẫu nhiên?
Sự so sánh giữa bất hoạt X in dấu và ngẫu nhiên đặt ra một câu hỏi quan trọng: Nếu tất cả các tế bào của phôi sớm tiền làm tổ đã vô hiệu hóa X của cha, tại sao lại cần phải tái kích hoạt nhiễm sắc thể X, chỉ để bất hoạt nó ngẫu nhiên một lần nữa? Một giả thuyết cho rằng có lẽ sự bất hoạt X ngẫu nhiên đã tiến hóa ở thú nhau để có thêm cơ hội đối phó với các đột biến liên kết với X. Cụ thể, nếu X của người cha luôn bị bất hoạt, điều này đặt gánh nặng cho sự biểu hiện tất cả các gen liên kết X từ mẹ. Do đó, động vật có vú có thể đã tiến hóa cơ chế bất hoạt X ngẫu nhiên để giảm bớt gánh nặng đột biến lên nhiễm sắc thể X của mẹ. Ví dụ, trong hội chứng Rett, những con cái mang bản sao gen MECP2 bị đột biến trên gen liên kết với X từ mẹ vẫn có thể sống sót, bởi vì X từ bố là một bản sao bình thường vẫn hoạt động trong một số tế bào [10].
Mặc dù XCI ngẫu nhiên đã rất hoàn thiện, một số lượng đáng kể các gen có thể thoát khỏi sự bất hoạt và vẫn hoạt động, ở lớp thú nhau và đặc biệt là ở người, mặc dù thực tế là XIST RNA bao phủ dọc theo toàn bộ nhiễm sắc thể X [5, 13]. Thực tế là một số gen nhất định có thể thoát khỏi sự bất hoạt và ảnh hưởng trực tiếp đến một số bệnh của con người trong đó có số lượng nhiễm sắc thể X bất thường. Ví dụ, nữ XO (hội chứng Turner), nữ XXX và nam XXY (hội chứng Klinefelter) đều có các khiếm khuyết về phát triển (bao gồm vô sinh và các vấn đề về tim bẩm sinh), mặc dù các X thừa đã bị bất hoạt ở những người XXX và XXY, trong khi X đơn của hội chứng nữ Turner vẫn hoạt động [10]. Các hội chứng này có thể được quy cho thực tế là các gen liên kết X thoát được XCI thường không được biểu hiện ở mức độ chính xác.
Nghiên cứu bất hoạt nhiễm sắc thể X: Viễn cảnh tương lai
Bất hoạt X đã được nghiên cứu trong hơn nửa thế kỷ, nhưng vẫn còn một số câu hỏi chưa được giải quyết. Ví dụ, tại sao tế bào đếm được chính xác số lượng X của nó? Làm thế nào sự bất hoạt diễn ra và duy trì ở cấp độ phân tử? Tại sao các RNA không mã hóa đóng một vai trò lớn như vậy trong XCI? Làm thế nào để một số gen quan trọng thoát khỏi tầm ảnh hưởng sâu rộng của XIST trên X bất hoạt?
Nghiên cứu về bất hoạt X cũng có thể cung cấp cái nhìn sâu sắc về sinh học ung thư, vì hai X hoạt động đã được tìm thấy trong nhiều khối u vú và buồng trứng của người [17]. Ngoài ra, quá trình bất hoạt X có thể vượt ra ngoài phạm vi của các gen liên kết X và được áp dụng cho nhiều rối loạn của con người liên quan đến in dấu gen – các gen được biểu hiện chỉ từ nhiễm sắc thể của một trong hai cha mẹ mà có vẻ cũng được điều hòa bởi các RNA không mã hóa [27]. Không còn nghi ngờ gì nữa, bất hoạt X đại diện cho một hệ thống mô hình tuyệt vời để nghiên cứu một loạt các quá trình phát triển và biểu sinh học.
Cơ chế hình thành màu lông mèo tam thể
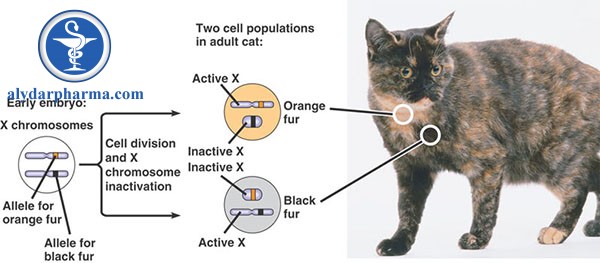
Mèo tam thể là cơ thể khảm do bất hoạt ngẫu nhiên 1 nhiễm sắc thể X trong giai đoạn phôi sớm. Sự bất hoạt truyền cho các tế bào con rồi đi về các vùng khác nhau trên cơ thể mèo. Màu trắng (không có sắc tố) ở mèo nói chung không phải do locus gene này quy định.
Trích dẫn và tham khảo
[1] Borsani, G., et al. Characterization of a murine gene expressed from the inactive X chromosome. Nature 351, 325–329 (1991) doi:10.1038/351325a0 (link to article)
[2] Boumil, R. M., & Lee, J. T. Forty years of decoding the silence in X-chromosome inactivation. Human Molecular Genetics 10, 2225–2232 (2001)
[3a] Brockdorff, N., et al. Conservation of position and exclusive expression of mouse Xist from the inactive X chromosome. Nature 351, 329–331 (1991) doi:10.1038/351329a0 (link to article)
[3b] The product of the mouse Xist gene is a 15 kb inactive X-specific transcript containing no conserved ORF and located in the nucleus. Cell 71, 515–526 (1992)
[4a] Brown, C. J., et al. A gene from the region of the human X inactivation centre is expressed exclusively from the inactive X chromosome. Nature 349, 38–44 (1991) doi:10.1038/349038a0 (link to article)
[4b] ___ The human XIST gene: Analysis of a 17 kb inactive X-specific RNA that contains conserved repeats and is highly localized within the nucleus. Cell 71, 527-542 (1992)
[5] Carrel, L., & Willard, H. F. X-inactivation profile reveals extensive variability in X-linked gene expression in females. Nature 434, 400–404 (2005) doi:10.1038/nature03479 (link to article)
[6] Clemson, C. M., et al. XIST RNA paints the inactive X chromosome at interphase: Evidence for a novel RNA involved in nuclear/chromosome structure. Journal of Cell Biology 132, 259–275 (1996)
[7] Costa, F. F. Non-coding RNAs, epigenetics, and complexity. Gene 410, 9–17 (2008)
[8] Duret, L., et al. The Xist RNA gene evolved in eutherians by pseudogenization of a protein-coding gene. Science 312, 1653–1655 (2006)
[9] Graves, J. A. Sex chromosome specialization and degeneration in mammals. Cell 124, 901–914 (2006)
[10] Ham, A. L., et al. Does genotype predict phenotype in Rett syndrome? Journal of Child Neurology 20, 768–778 (2005)
[11] Hornecker, J. L., et al. Meiotic sex chromosome inactivation in the marsupial Monodelphis domestica. Genesis 45, 696–708 (2007)
[12] Huynh, K. D., & Lee, J. T. X-chromosome inactivation: a hypothesis linking ontogeny and phylogeny. Nature Reviews Genetics 6, 410–418 (2005) doi:0.1038/nrg1604 (link to article)
[13] Johnston, C. M., et al. Large-scale population study of human cell lines indicates that dosage compensation is virtually complete. PLoS Genetics 4, e9 (2008)
[14] Lee, J. T. Disruption of imprinted X inactivation by parent-of-origin effects at Tsix. Cell 103, 17–27 (2000)
[15] Lee, J. T., & Lu, N. Targeted mutagenesis of Tsix leads to nonrandom X inactivation. Cell 99, 47–57 (1999)
[16] Lee, J. T., et al. Tsix, a gene antisense to Xist at the X-inactivation centre. Nature Genetics 21, 400–404 (1999) (link to article)
[17] Liao, D. J., et al. Novel perspective: Focusing on the X chromosome in reproductive cancers. Cancer Investigation 21, 641–658 (2003)
[18] Lucchesi, J. C., et al. Chromatin remodeling in dosage compensation. Annual Review of Genetics 39, 615–651 (2005)
[19] Luikenhuis, S., et al. Antisense transcription through the Xist locus mediates Tsix function in embryonic stem cells. Molecular and Cellular Biology 21, 8512–8520 (2001)
[20] Lyon, M. F. Gene action in the X-chromosome of the mouse (Mus musculus L.). Nature 190, 372–373 (1961) doi:10.1038/190372a0 (link to article)
[21] Martin, G. R., et al. X-chromosome inactivation during differentiation of female teratocarcinoma stem cells in vitro. Nature 271, 329–333 (1978) (link to article)
[22] Namekawa, S. H., et al. Sex chromosome silencing in the marsupial male germ line. Proceedings of the National Academy of Sciences 104, 9730–9735 (2007)
[23] Okamoto, I., & Heard, E. The dynamics of imprinted X inactivation during preimplantation development in mice. Cytogenetic and Genome Research113, 318–324 (2006)
[24] Penny, G. D., et al. Requirement for Xist in X chromosome inactivation. Nature 379, 131–137 (1996) doi:10.1038/379131a0 (link to article)
[25] Rastan, S., & Robertson, E. X chromosome deletions in embryo-derived (EK) cell lines associated with lack of X chromosome inactivation. Journal of Embryology and Experimental Morphology 90, 379–388 (1985)
[26] Sado, T., et al. Regulation of imprinted X-chromosome inactivation in mice by Tsix. Development 128, 1275–1286 (2001)
[27] Sleutels, F., & Barlow, D. P. The origins of genomic imprinting in mammals. Advances in Genetics 46, 11–163 (2002)
[28] Stavropoulos, N., et al. A functional role for Tsix transcription in blocking Xist RNA accumulation but not in X-chromosome choice. Proceedings of the National Academy of Sciences 98, 10232–10237 (2001)
[29] Wutz, A., & Jaenisch, R. A shift from reversible to irreversible X inactivation is triggered during ES cell differentiation. Molecular Cell 5, 695–705 (2000)
[30a] Xu, N., et al. Transient homologous chromosome pairing marks the onset of X inactivation. Science 311, 1149–1152 (2006) doi:10.1126/science.1122984
[30b] ———. Evidence that homologous X-chromosome pairing requires transcription and Ctcf protein. Nature Genetics 39, 1390–1396 (2007) doi:10.1038/ng.2007.5 (link to article).
Nguồn: tapchisinhhoc.com









